第12回(平成24年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
多能性幹細胞からの自己組織化による脳および感覚組織の3次元立体構築技術の開発
| 受賞者 | ||
|---|---|---|
| 笹井 芳樹 (ささい よしき) | ||
| 略歴 | ||
| 1986年 | 3月 | 京都大学 医学部 卒業 |
| 1992年 | 3月 | 京都大学大学院 医学研究科 修了 |
| 1993年 | 3月 | UCLA研究員 |
| 1996年 | 6月 | 京都大学 医学研究科 助教授 |
| 1998年 | 5月 | 京都大学 再生医科学研究所 教授 |
| 2003年 | 7月 | (独)理化学研究所 発生・再生科学総合研究センター グループディレクター(専任) |
| 現在に至る | ||
授賞理由
笹井芳樹氏は、両生類やほ乳類の初期胚を用いて、神経組織の発生をスタートさせる「神経誘導因子」の分子実体を明らかにし、これまで長年謎であった脳発生の分化制御機構を解明した。これらの研究をさらに発展させ、脳発生を制御する遺伝子やそのネットワークを次々と明らかにし、複雑な脳や感覚組織の形成の原理を確立して来た。
今回、笹井氏はこれらの原理に基づいて、マウスやヒトのES細胞、iPS細胞の試験管内分化法及びその大量培養法の開発を進め、大脳、小脳、視床下部等のニューロン、ドーパミン神経細胞、網膜細胞などの中枢神経系細胞の高効率な分化誘導技術の開発に世界で初めて成功した。これらはパーキンソン病などへの移植による再生医療の基盤技術として、臨床研究への応用が可能である。これら細胞の分化誘導技術の開発に加えて、特に、近年、笹井氏は、細胞の分化誘導胚発生の微小環境を制御して、生体と同じく3次元的に組織の立体構築技術の開発に取り組み、ES細胞などの多能性幹細胞からの3次元立体組織の形成法の技術開発に成功した。そして、これまで困難とされてきた複雑な層構造を有する生体と同じ網膜組織、更には機能的な脳下垂体組織の3次元立体構築の技術開発に世界で初めて成功した。これらは、次世代の再生医療を開く画期的なイノベーションとなりうるものである。
以上の理由により、笹井芳樹氏を第12回山崎貞一賞バイオサイエンス・バイオテクノロジー分野の受賞者とする。
研究開発の背景
脳や網膜などの組織は、再生能が低く、一旦障害を受けると自然に回復することは難しい。そのため、神経変性疾患や網膜変性疾患などは多く存在するが、有効な治療法がない。それらに対し、多能性幹細胞から障害を受けた細胞や組織を試験管内で産生し、移植する「再生医療」は合理的なアプローチであるが、そのため必要となる細胞材料の調製には未だ困難な点も多い。
哺乳類を含む脊椎動物の中枢神経系は、体の中でも最も複雑な器官であり、その精緻な発生のメカニズムは生物学の大きな謎である。この複雑な発生をES細胞やiPS細胞を用いて試験管内で再現して、脳の細胞や組織のパーツを産生することができれば、再生医学や創薬研究などに大きな貢献が期待できるが、その難度は高かった。
特に、複雑な構造を持つ大脳皮質や網膜は、多数の種類の細胞が多層をなして構築されている。従来の研究でも、簡単な組織の構築では、高分子材料と細胞の組み合わせによる所謂ティッシュエンジニアリングで一定の成果の報告があったが、大脳皮質や網膜などの高度に複雑な組織構築は全く不可能であった。本受賞者は、こうした脳組織の形成を胚発生過程で解析し、その微小環境を試験管内で再現することにより、それらの組織が内在性に有する「自己組織化」の能力を引き出し、自発形成を行なうことに成功したものである。
業績内容
ES細胞、iPS細胞などの多能性幹細胞は、再生医療における細胞移植に必要な有用細胞を作成する材料の切り札として期待されている。本受賞者は、多能性幹細胞を医療応用するために解決すべき2つの大きな技術課題の解決に取り組み、下記のように研究成果を挙げた。
A)多能性幹細胞から各種の中枢神経系ニューロン(大脳、中脳、小脳、視床下部など)への選択的な分化培養法を確立し、その制御原理を解明した(図1)(渡辺ら、Nature Neuroscience, 2005; 笹井ら、Cell, 2008; 綿谷ら、PNAS, 2008; 六車ら,Nature Neuroscience, 2010; 上谷ら、Nature, 2011;その他)。
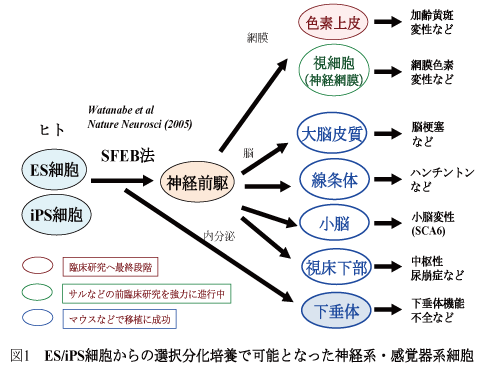
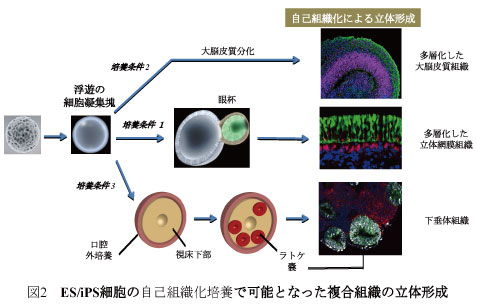
さらに、多能性幹細胞の3次元培養による自己組織化技術を確立し、大脳皮質、眼(網膜)組織および脳下垂体組織の立体組織形成を試験管内で成功した(図2)(永楽ら、Cell Stem Cell, 2008; 永楽ら、Nature, 2011; 須賀ら、Nature 2011)。
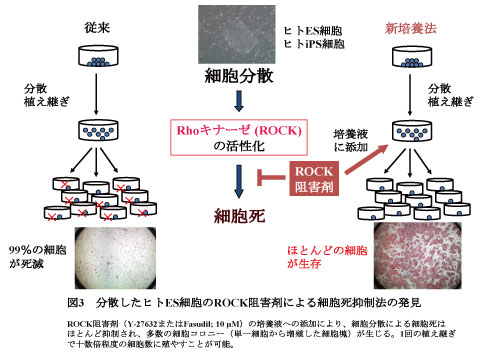
B)従来のヒトES・iPS細胞の研究開発で、実用上大きな問題であったのは「分散培養過程における高頻度の細胞死」であり、そのためヒトES細胞やiPS細胞の大量培養は現実的に困難であった。本受賞者は、その原因が細胞内のRhoキナーゼの活性化であることを解明し、Rhoキナーゼ阻害剤を用いることで、この細胞死を抑制できることを発見した(図3)(渡辺ら、Nature Biotechnology, 2007; 大串ら、Cell Stem Cell, 2010)。
本受賞者が確立したこのRhoキナーゼ阻害剤法は現在世界的な標準技術として広く受け入れられ、ヒト多能性幹細胞とその分化細胞の大量培養を可能にした(図4)。
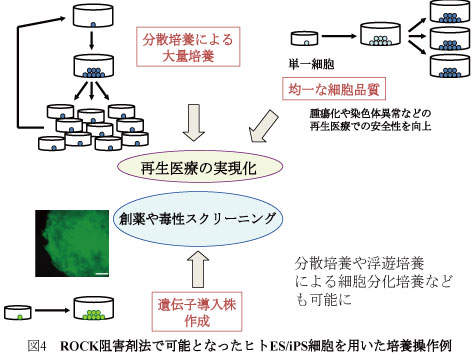
さらに、細胞死が原因でヒトES・iPS細胞で実施が難しかった細胞クローニング(単一細胞からのコロニー形成)やそれを用いた遺伝子ノックアウト技術などについても、ROCK阻害剤の利用で可能となった。また、医療応用面においても細胞クローニングによる高いレベルの品質管理が可能になった。
本業績の意義
本受賞者は、上記のように、ヒト多能性幹細胞の大量培養法を確立し、さらに、発生の原理をもとに多能性幹細胞からの各種の脳領域のニューロンの選択的分化培養法を確立するなど、中枢神経疾患に対する再生医療の可能性を大きく拡げた。
ES・iPS細胞から網膜細胞(色素上皮細胞)の分化誘導技術ついては、加齢黄斑変性症などへの移植治療を目指した前臨床研究に応用され、先端医療センター(神戸市)を中心にしたグループでの臨床応用に向けた計画が高橋政代博士らに進めている。色素上皮細胞のヒトへの移植開発は、特に先行して進んでおり、早期の臨床試験の開始が期待されている。
また、動物およびヒトES細胞から中脳ドーパミン神経細胞への試験管内分化誘導にも早くから成功し、高効率での産生や細胞純化を可能としたが、京都大学脳外科学教室、再生医科学研究所、iPS細胞研究所などとの共同研究により、ES細胞由来のドーパミン神経細胞をパーキンソン病モデル・カニクイサルの脳へ移植することで有意の治療効果を認め、ES細胞を用いたサルレベルの前臨床研究の成功は世界で初めての報告につながった。
自己組織化による大脳皮質組織や多層網膜の立体形成や機能性のある脳下垂体(内分泌中枢器官)の立体形成に成功したが、これらは従来の細胞移植を越えた、多能性幹細胞による「機能組織の移植」を可能とする画期的な成果である。新しい発想の「立体複合組織」の人工形成技術と考えられ、再生医療を飛躍的に推進するイノベーションとして大きく期待される。これらの技術は、再生医療のみならず、患者iPS細胞技術と組み合わせることで疾患モデルを組織レベルで解析することも可能とし、創薬や病因研究などの優れたツールを提供すると考えられる。
