第10回(平成22年度)山崎貞一賞 計測評価分野
高速原子間力顕微鏡の開発と生体分子の動態観察への応用
| 受賞者 | ||
|---|---|---|
| 安藤 敏夫 (あんどう としお) | ||
| 略歴 | ||
| 1980年 | 3月 | 早稲田大学大学院 理工学研究科 博士課程修了 (理学博士) |
| 同年 | 4月 | カリフォルニア大学 サンフランシスコ校 博士研究員 |
| 1983年 | 1月 | カリフォルニア大学 サンフランシスコ校 助手 |
| 1986年 | 3月 | 金沢大学 理学部 講師 |
| 1992年 | 8月 | 金沢大学 理学部 助教授 |
| 1996年 | 7月 | 金沢大学 理学部 教授 |
| 2009年 | 4月 | 金沢大学 理工研究域数物科学系 教授 |
| 現在に至る | ||
授賞理由
生体分子の構造と機能との関係ならびに機能が生まれる仕組みを理解するには、生体分子が機能している場でその動態を直接観察する必要がある。この要求を満たすために、安藤敏夫氏は原子間力を用い高速で動作する走査型顕微鏡を開発した。
走査型顕微鏡の画質を左右する画素数が増すと、画素の集合である画像の生成時間が増加する。画質と画像生成速度とはトレードオフの関係があり、画質と速度に限界が存在した。安藤氏は限界を打破し、水溶液中や細胞中の生体分子の動きの直接観測を可能にした。
画質を保持し高速化するため、試料を載せた台をX,Y,Z軸方向にピエゾアクチュエータにより高速度で正確に駆動し、位置に対応した画像を得る。超小型の探針が試料表面に接近した際、試料との間に作用する原子間力による探針の微小変位を光学的に検出し、適切な原子間力が常に作用するようにZ軸のピエゾが駆動されるフィードバック制御系が動作する。X,Y軸は試料表面を一定間隔で2次元的に走査する制御系であり、高画質と走査速度を確保するには2次元の走査が高速度で、不要な振動を抑制しなければならない。Z軸の制御を高速化するため、制御系各要素の動特性を改善すべく、能動的な振動抑制や非線形制御などの手法を活用した。この結果、従来1画面の形成に最小30秒程度を要したが、毎秒10〜25画面が得られ、300〜750倍の高速化を実現した。
成果は多数の論文や特許となり、企業により装置が生産され、世界の研究者に使われている。
応用例として光を受けたバクテリオ・ロドプシン膜の分子の挙動を画像化した成果がNATURE Nanotechnologyに掲載された。
本業績はバイオ科学の発展に大きく貢献する成果であり、計測評価分野の山崎貞一賞にふさわしい。
研究開発の背景
タンパク質が機能する仕組みの理解には、機能している場で構造とダイナミクスを同時に且つ高い解像度で直接観察することが最も直接的なアプローチである。しかし、構造を観察する技術、ダイナミクスを観察する技術は存在しても、それらを同時に観察する技術は存在しなかった。生命科学全体を長い間支配してきたこの技術的限界を打破すべく、原子間力顕微鏡 (AFM) の高速化に向けた研究に着手した。今から15年以上前のことである。後で分かったことだが、同じ時期に米国UCSBのPaul Hansmaも高速化の研究に着手していた。
業績内容
AFMでは、柔らかいレバー(カンチレバー)先端に付いた探針を試料表面に近づけ、或いは、接触させて、探針・試料間にかかる力をカンチレバーの力学的変化(たわみ、振幅、位相、或いは、共振周波数の変化) を介して計測する(図1)。実際には、力学的変化を一定に保つように、探針と試料間のZ方向の距離をフィードバック制御により調節する。この計測とフィードバック制御走査を試料全体に亘り行うことにより、試料全体の表面構造を見る。液中に在る試料でも2-3ナノメータの空間分解能で観察できる。しかし、探針と試料の水平方向の相対位置を変えながら試料の1点1点毎に計測・フィードバック制御走査を繰り返すため、1画像を撮るのに通常分のオーダの時間を要する。

図1:カンチレバー探針で試料表面の1点1点に触りながら試料の全体像を撮るAFMの原理と
ミオシンVの歩行過程(左下)を示す模式図。
AFMの高速化の要点は3つある。第1に、フィードバック制御を高速化すること、第2に、試料ステージスキャナーを高速に走査したときに発生する不要な振動を抑制すること、第3に高速性と低侵襲性を両立させること。フィードバック制御を高速化するためには、AFMに含まれる全ての要素デバイスの応答速度を上げなければならない。そこで、共振周波数の高い微小カンチレバー、微小カンチレバーに適用できる光てこ光学系、高速スキャナー、高速振幅計測回路、高速ピエゾドライバー、高速センサなどを開発した。振動抑制技術として、スキャナーの振動特性をLRC回路で模擬し、その回路の出力を利用する手法などを開発した。高速性と低侵襲性を両立させるために非線形特性をもつフィードバック制御法を開発した。これらの技術開発の多くは国内外に出願し、既に数件が特許登録されている。
以上の開発を全て進めた結果、フィードバック帯域は100 kHzを越し、250 nm2四方の走査領域、100本の走査線の条件で、1画像を30-100 msで撮れる世界最高性能の高速AFMが完成した。重要なことに、弱いタンパク質間相互作用を乱さずに高速イメージングできる。Paul Hansmaのグループは0.5秒/フレームのイメージング速度を達成したものの、開発を止め、骨のイメージング研究に移った。後続の英国Bristol大のMervin Milesのグループはフィードバック走査をしない手法でビデオレートを越すイメージング速度を達成したが、生物試料の動態観察は到底できない。
高速AFM観察がタンパク質の研究に有効であることを実証するために、いくつかのタンパク質系の動態イメージングを行った。例えば、モータタンパク質ミオシンVのアクチンフィラメントに沿った歩行運動(図2) や光駆動型プロトンポンプであるバクテリオロドプシンの光に対する応答を高解像の映像として捉えることに成功した。分子映像の中には、これまでの研究で明らかにされた複数の事実が視覚的証拠として同時に現れるだけでなく,未知であった分子の振舞いも観察された。ミオシンVの例では、構造とダイナミクスの観察から、この分子がどのように力を発生し、一方向の歩行運動を可能にしているかを従来の手法によるよりも遥かに詳細に解明することができた。
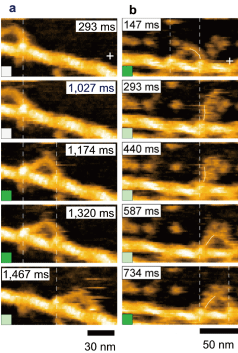
図2:ミオシンVの歩行運動を捉えた高速AFM像。歩行を緩やかに阻害する粒子が基板にない場合
1ステップ移動の途中の過程は速すぎて見えていないが(a)
粒子がある場合には、前足と後ろ足の動態が観察される(b)
本業績の意義
開発した初期バージョンの装置は国内で8台が研究機関に販売され活用されている。最新バージョンの装置は海外の6つの研究機関で最近利用され初め、既に研究成果が何編かの論文として発表されており、我々の開発した装置の実用性が広く実証されている。ミオシンVの例でも分かる通り、構造とダイナミクスを同時に映像として視覚化する手法は、従来の手法とは比較にならないくらい直接的で明快である。従来の手法ではひとつの事実を見出すだけでも、多くの研究者の努力と時間が必要であった。一方、高速AFMではタンパク質が働くときの動作の詳細が分子映像として包括的に現れるため、複数の事実を一挙に解明でき、働く仕組みの理解が容易になる。今後この装置が更に世界に普及し、多様な生体分子の機能解明が加速されるものと予想される。また、高速AFMは、バイオに限らず液中の固液界面で起こるナノメータスケールの動的現象の解明にも活用され、新しいナノテクノロジーの創成にも貢献するものと期待される。
