第3回(平成15年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
実用的な無細胞タンパク質合成法の確立
| 受賞者 | ||
|---|---|---|
| 遠藤 弥重太 (えんどう やえた) | ||
| 略歴 | ||
| 1975年 | 2月 | 徳島大学大学院 栄養学研究科博士課程 修了 |
| 1979年 〜'84年 |
7月 3月 |
徳島大学 医学部 講師 |
| 1980年 〜'82年 |
10月 8月 |
シカゴ大学研究員(生命科学研究所) |
| 1984年 | 4月 | 山梨医科大学 助教授(生化学講座) |
| 1992年 | 5月 | 愛媛大学 工学部 教授 |
| 2003年 | 4月 | 同 無細胞生命科学工学研究センタ− センタ−長 |
| 現在に至る | ||
選考理由
ヒトゲノム解読完了を受けポストゲノム期に入った現在、ライフサイエンスの最重要課題として遺伝子発現の産物であるタンパク質の機能・構造の解析が、プロテオミックスの名称のもとに採りあげられている。ここにおいて、タンパク質の機能性御とその応用を目指す創薬を始めとする新しいライフテクノロジーの創出が期待されるに至った。遠藤弥重太氏が開発した独創的な無細胞タンパク質合成法はこの期待に答えるものである。
従来のタンパク質調製技術としては、直接生物材料から精製する方法や、近年では大腸菌や酵母など生きている細胞に遺伝子を導入し、その遺伝子情報によって生合成されたタンパク質を精製単離する細胞生化学的方法などが用いられてきた。しかし、いずれも、得られるタンパク質の量、質、コスト上に種々の問題点をかかえている。また、生細胞を使うことから生命倫理上からも問題無しと云えない事情にある。遠藤氏は、タンパク質生合成工場とも云えるリボソームについての、多年にわたる地味な基礎研究から得た知見を基に、無細胞タンパク質合成系の樹立に挑戦し、画期的な技術の開発に成功した。 すなわち、従来の生材料を用いた場合に不可避とされていた生成タンパク質の不安定化現象を生化学的に解明し、その成果を基に植物材料であるコムギ胚芽に注目、この不安定現象の制御に成功。このコムギ胚芽を材料として活用することによって、細胞無しで遺伝子情報(DNA)を基に試験管内で、従来法に比べて遥かに多量かつ多種類のタンパク質を高効率に短時間で合成することに成功した。これにより世界で始めて、遺伝子情報を活用する実用的な、タンパク質の試験管内合成法が確立されたといえる。 本技術では生きた生命体を利用しないうえ、出発材料としての情報DNAが任意に自動合成できる現在、遠藤氏によって開発された新技術は、天然に無い新しいタイプのタンパク質の合成をも可能にした。これは従来のタンパク質分子種の範囲を、生命体を越えて飛躍的に拡張し、人工タンパク質の創出をも可能にしたと云ってよい。ライフサイエンス、ライフテクノロジー分野のみならず21世紀の基礎科学分野と材料・計測科学技術産業にも大きな可能性を拓くものと期待できる。
本研究と技術はすべて遠藤氏のチームだけでおこなわれたことも特筆できる。従って我が国が世界に発信できる独自のバイオテクノロジーであるとともに、基礎および応用研究に対して波及効果の大きいテクノロジーであり、山崎貞一賞に値する。
研究の背景
遺伝情報から高品質のタンパク質をハイスループット合成する技術を確立することは、ポストゲノム研究に向けた今日の必須課題です。タンパク質の調製には遺伝子断片を大腸菌のような生物体に導入し、生細胞内で合成したタンパク質を用いる、細胞工学的手法が主流です。この手法は、ある程度の成功を収めてきていますが、熟練した技術と労力、コストを要する他に、品質が低く特に生命体に重要な生理機能を営むタンパク質は宿主生理をかく乱するために合成できない場合が多いなど、多くの欠点があります。一方、タンパク質の有機合成法は収率的に非現実的です。無細胞タンパク質合成法とは、生体内で機能している遺伝情報翻訳系のエッセンスを取り出し、人工容器内でタンパク質を合成させる生物学と化学を融合した手法です。しかし、従来からの無細胞法では反応が1時間程で停止するため、タンパク質の調製手段にはなり得ないと考えられてきました。超分子複合体である翻訳系というものは生来不安定であり、細胞から機能をそこなうことなく試験管内に取り出すことは不可能であると信じられてきたからです。本研究では、毒素を分子探査針としたリボソームなどタンパク質合成機作の研究から得た常識を覆す発見をもとにして、無細胞系の安定化に成功し、世界初の実用的な無細胞タンパク質合成システムを完成させました。このシステムでは、生命体としての生理学的制約を受けることがないので、生体構成タンパク質種を越えて、合成可能な分子種を殆ど無限大にまで広げることが期待できます。
業績内容
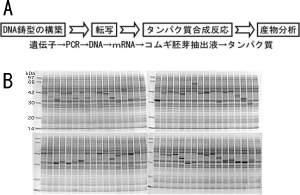
リボソームを標的とする赤痢毒素や大腸菌O157ベロ毒素など一群の細胞毒素の分子機構の解明と、それらを探査針とした遺伝情報翻訳メカニズムの研究から、生命体には翻訳機構を標的とする自殺システム(自己防御機構)を備えていること、そして、無細胞タンパク質合成反応の不安定化現象は細胞破壊に伴う自殺因子群の起動に起因することを見いだしました。コムギ種子においては、翻訳反応不活性化タンパク質因子群が胚乳組織に局在するが、それらの自殺因子を除去した純化胚芽(図1)から抽出液を調製すると、タンパク質合成反応が2週間持続し、従来の千倍を超える合成効率を達成することができました(図2)。この技術を基盤として実用的なコムギ胚芽無細胞タンパク質合成法の確立を目指して、(1)高翻訳鋳型活性を持つmRNAの設計、(2)PCR法を用いる転写用鋳型DNAの構築と、専用転写ベクターの設計、(3)タンパク質の多品種少量および大量合成用の二種類の合成反応法の開発など、を進めました。それらの要素技術を組み合わせることによって、生細胞を用いることなく、実用レベルの試験管内タンパク質合成が可能となりました(図3)。全反応過程を自動化し、タンパク質合成ロボットの開発にも成功しました(図4)。
 |
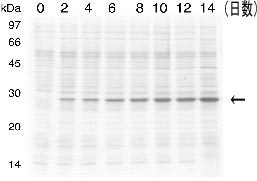 |
| 図1 洗浄によって白色の胚乳成分(左図)が排除された乳白色のコムギ胚芽純品を得ることができた(右図)。 | 図2 安定・効率化したコムギ胚芽無細胞システム。クラゲ蛍光タンパク質(矢印)の合成例の電気泳動図で、2週間の反応で1ml当たり9.7mgの合成率を示した。 |
 |
 |
| 図3 コムギ胚芽無細胞タンパク質合成の手順(A)と、電気泳動による合成産物の分析例(B)。各レーンの濃いバンドが合成産物で、他は胚芽タンパク質。 | 図4 全自動タンパク質合成ロボット、GenDecoder。 |
本業績の意義
(実用性)構造・機能ゲノム、プロテオミクス、ゲノム創薬等々、ポストゲノム時代の新たな基礎・応用生命科学の時代を迎えています。しかし、従来からの大腸菌などを利用する細胞工学法にはタンパク質の発現、標識、精製法、品質やスループットに大きな限界がありました。中でもタンパク質合成過程における立体構造化メカニズムが真核生物と原核生物間では異なるため、従来の大腸菌などを用いる方法では高等生物遺伝子から活性を保持したタンパク質を生産することには大きな限界がありました。本合成法においては、原核生物から高等動物までのタンパク質を高品質で得ることができ、創薬や診断、ワクチン用の抗原タンパク質の調製法として特性を発揮します。また、本法は食品である小麦を材料としていることから、将来の医薬品大量生産に向けてはバイオハザードが最小で安全且つ安価、また生命倫理の観点からも優れたタンパク質生産システムとして期待できます。
(発展性)ゲノム情報が蓄積してきている現在においてもタンパク質の機能・構造が解析されている分子種は限られています。この事実は、これまで高品質タンパク質を自由自在に得る手段がなかったためであると言えます。本法は従来の発現法の欠点を打破する有効なタンパク質合成手段を提供するでしょう。本タンパク質合成法は、ヒトを含む地球表面の生物の他にも、極限環境生物や地球外生命体をも対象とする利用範囲の広い技術であると思われ、新たな学問分野の開拓に力を発揮することが期待できます。さらに、本法においては、化学合成遺伝子からタンパク質合成までの過程をすべて試験管内でおこなうことが可能です。従って、ゲノムワイドな利用のみでなく、進化の過程で生命体が選択しなかった分子など、殆ど無限大のアミノ酸配列空間から人類に有用なタンパク質分子種を採掘する手段ともなり得ます。本技術は、これまでのバイオの常識を越えて、新産業分野を開く可能性を秘めています。

