第11回(平成23年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
燐脂質を利用した膜蛋白質の結晶化技術の開発と カルシウムポンプ作動機構の解明
| 受賞者 | ||
|---|---|---|
| 豊島 近 (とよしま ちかし) | ||
| 略歴 | ||
| 1978年 | 3月 | 東京大学 理学部物理学科 卒業 |
| 1983年 | 3月 | 東京大学大学院 理学系研究科 物理学専攻 博士課程修了 |
| 1988年 | 4月 | 英国MRC分子生物学研究所 研究員 |
| 1989年 | 7月 | 理化学研究所 国際フロンティア研究員 |
| 1990年 | 1月 | 東京工業大学 理学部(生命理工学部)助教授 |
| 1994年 | 5月 | 東京大学 分子細胞生物学研究所教授 |
| 現在に至る | ||
授賞理由
豊島近氏は、細胞の膜を介してカルシウムイオンを運搬するカルシウムポンプという、生命活動に必須なタンパク質の構造解析に、ほぼ独力で取り組んだ。作用中に変化する4つの基本状態全ての原子配置構造を決定したのみならず、それらの中間(励起)状態まで、計8つの結晶構造を明らかにした。同一のタンパク質の構造変化の経路がここまで詳細に示されたのは、水溶性タンパク質および膜タンパク質を含めて世界初である。
成功の鍵は、結晶化に際して膜タンパク質の状態を緻密に制御して、中間体を安定化させることにあった。例えば従来の常識に反する燐脂質の添加、それを含めた試料組成の結晶化過程全体を通じた繊細な条件制御など、これまでに確立された方法論に囚われない様々な工夫によって中間体の構造までをも示したことが、後に続く研究者の励みとなり、更に駆動力となるばかりでなく、この成果を応用したカルシウムポンプの研究の発展にも貢献している。
重要な生理機能の多くは膜タンパク質に担われており、創薬の重要なターゲットでもある。その機能・構造の解析はなかなか進まなかったが、最も困難な問題を解決した豊島氏の成果は国際的にも高く評価されており、豊島氏の研究成果、研究手法を用いて、この分野の今後のさらなる大きな、かつ急速な発展が期待される。4つの基本状態全ての原子配置構造を決定し、それらの中間(励起)状態まで、計8つの結晶構造を明らかにしたことは、今後それぞれの中間体に対する創薬研究という方向性を見いだしたことを示し、創薬研究全体に大きなインパクトを示すものである。
以上の理由により、豊島近氏を第11回山崎貞一賞バイオサイエンス・バイオテクノロジー分野の受賞者とする。
研究開発の背景
膜蛋白質の三次元結晶化は困難なことで有名であり、ハイリスク・ハイリターン研究の代表的なものである。最初の結晶化はドイツのH. Michelによって光合成細菌の反応中心に関して成され、その業績に対して1988年のノーベル化学賞が授与された。Michelは界面活性剤によって可溶化した膜蛋白質の結晶解析のためには、燐脂質を除去し生体中とは全く異なるパッキングの結晶(2型結晶。図1)を作製する必要があり、天然の状態である脂質二重膜に埋まったものが積み重なった結晶(1型結晶)は大きくならないので駄目であると主張した。また、燐脂質は本来不均一であり、結晶化に悪影響を与えるとした。この主張は広く信じられ、言わば常識となっていた。また、X線レベルの三次元結晶化には専ら蒸気拡散法が用いられ、電子顕微鏡レベルの結晶化には界面活性剤を透析で除いて脂質二重膜(二次元結晶)を形成させる方法が用いられることなどから「X線と電顕の結晶化は本質的に異なる」と信じられていた。
骨格筋のCa2+ポンプ蛋白質(SERCA1a)は天然に大量に存在し、精製法も1970年には確立していた。従って、言ってみれば誰でも結晶化できる数少ない膜蛋白質であり、その後20年以上にわたって結晶が出来たという噂が現れては消えて行った。電子顕微鏡レベルの結晶は得られたが、活性を失わずに燐脂質を除くこと、X線にかかるまでに結晶を大きくすることは誰にも出来なかった。

図1 膜蛋白質三次元結晶のパッキングと
Ca2+ポンプ蛋白質の種々の状態の三次元結晶
業績内容
Ca2+ポンプ蛋白質に取り組み始めたのは1980年代中頃である。最初は電子顕微鏡によるチューブ状結晶の三次元像再構成技術を開発し、Ca2+非結合時の最初の立体構造を得た。一方、Ca2+存在下で良質の電子線回折パターンを与える三次元超薄微結晶の作製には成功したが、X線結晶解析にかかるほどのものは得られなかった。ではあるが、X線と電顕の結晶化に本質的差はないと考え、手法的には電顕のものの拡張を追及することにした。実際、Ca2+ポンプ蛋白質の場合、燐脂質の添加は精製時に活性を保つために必須であり、両者の差は単に「沈殿剤を有効に利用するかどうか」であると考えたからである。
このような、常識に反する試みの結果、2.6 Å分解能という当時の膜蛋白質結晶としては高分解能でCa2+ポンプ結晶構造の決定に成功した。2000年のことである。これは金属イオンポンプ初の構造決定であり、しかも、生体の制御に最も広範に使われるイオンであるCa2+のポンプであることから、非常に大きなインパクトがあった。さらに、この燐脂質を用いた結晶化技術と、燐酸の類似体として金属フッ素複合体を利用することによって、Ca2+ポンプの反応サイクルをほぼ完全にカバーする8つの中間状態の構造決定に成功した(図1,2)。この結果、濃度勾配に逆らってイオンを輸送するメカニズムの大略を原子構造から理解できるようになった。また、この結果明らかになった構造変化の大きさは、誰も予想し得なかったものであり、例えば、堅く噛み合っているはずの膜貫通ヘリックス間の大きなすべり運動など、これまでの常識を大きく覆すものであった。さらに、イオンポンプは運搬メカニズムの一部として脂質二重膜を利用していることが判明し、脂質二重膜の生理的役割に新しい光を当てることにもなった。
この結晶化技術は、電子顕微鏡用の二次元結晶化技術の発展であるとはいえ、三次元結晶化への応用は容易なものではなかった。結晶化に当たっては数多くの因子があり、そのすべてが正しく設定されて初めて成功するものである。そもそも、何が重要な因子であるかすら分かっていなかった。例えば、燐脂質の種類(単一鎖長か混合物か、飽和・不飽和脂肪酸の割合等)、蛋白質:燐脂質:界面活性剤の量比は、結晶化の成否を左右する重要な因子であり、系統的探索を要した。従って、再現性を向上するための多くの工夫が必要であった。特に、燐脂質と界面活性剤の迅速・簡便な定量法の確立が重要であった。
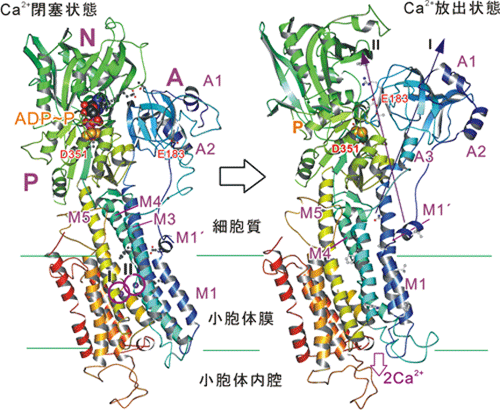
図2 膜内に閉じ込めた2個のCa2+(I, II)を放出する直前と直後の状態に対応するCa2+ポンプの結晶構造。 Aドメインは軸Iの周りに90°回転する。リボンはα螺旋を、矢印はβシートを示す。
本業績の意義
この研究の成功に伴って、他のグループも積極的に燐脂質を加えて結晶化に成功するようになり、膜蛋白質の構造解析の発展に大きく寄与すことになった。特に、本来、脂質二重膜中で機能する膜蛋白質の構造解析が天然に近い状態で可能であることを証明したことの意義は大きい。また、ここまで詳細に反応機構を構造的に理解できた蛋白質は、水溶性のものを含めてもほとんど無い。
高分解能の結晶構造に基づく薬剤のデザインは、試行錯誤を著しく軽減し、開発にかかる時間と費用の飛躍的短縮を可能性する。これからの創薬のターゲットの大部分は膜蛋白質であるといわれ、特に、高等動物の膜蛋白質の構造研究が医学・創薬の点からは重要である。一方、従来の方法で結晶化できるものを探索し構造決定を行う現状では、類縁の蛋白質ではあってもほとんどはバクテリアのものであり、高等動物膜蛋白質の構造決定は実に数少ない。燐脂質を積極的に添加することにより、結晶化可能な膜蛋白質の範囲は大きく拡大する。従って、その重要性は今後著しく増大するであろう。実際、燐脂質を積極的に取り入れることによって結晶化が初めて成功した例が幾つも知られてきている。
