第13回(平成25年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
塩酸イリノテカン:世界初のカンプトテシン系抗がん剤の開発
| 受賞者 | ||
|---|---|---|
| 宮坂 貞(みやさか ただし) | ||
| 略歴 | ||
| 1960年 | 3月 | 東京大学大学院化学系研究科薬学専門課程 修了 |
| 1960年 | 4月 | 東京医科歯科大学 文部教官 助手 |
| 1965年 | 3月 | 東京大学大学院 薬学博士号取得 |
| 1968年 | 10月 | 昭和大学 助教授(薬学部薬品製造化学) |
| 1978年 | 4月 | 昭和大学 教授 (薬学部 薬品製造化学教室主任教授) |
| 1997年 | 4月 | 昭和大学薬学部長、学校法人昭和大学理事 |
| 1999年 | 4月 | 昭和大学名誉教授 |
| 2004年 | 4月 | 学校法人昭和大学監事 |
| 現在に至る | ||
| 受賞者 | ||
|---|---|---|
| 澤田 誠吾(さわだ せいご) | ||
| 略歴 | ||
| 1978年 | 3月 | 昭和大学大学院薬学研究科博士後期課程 修了 |
| 1978年 | 4月 | (株)ヤクルト本社入社 中央研究所研究員 |
| 2002年 | 4月 | (株)ヤクルト本社 主席研究員 |
| 2007年 | 4月 | (株)ヤクルト本社 中央研究所審議役 |
| 2007年 | 10月 | (株)ヤクルト本社 特別研究員 |
| 現在に至る | ||
| 受賞者 | ||
|---|---|---|
| 横倉 輝男(よこくら てるお) | ||
| 略歴 | ||
| 1969年 | 3月 | 静岡県立静岡薬科大学大学院 薬学研究科修士課程 修了 |
| 1969年 | 4月 | (株)ヤクルト本社入社 中央研究所研究員 |
| 1973年 | 12月 | 静岡県立静岡薬科大学大学院薬学研究科 薬学博士号取得 |
| 1999年 | 6月 | (株)ヤクルト本社 取締役中央研究所長 |
| 2005年 | 6月 | (株)ヤクルト本社 専務取締役医薬品本部長 |
| 2011年 | 7月 | (株)ヤクルト本社 退社 |
| 現在に至る | ||
授賞理由
がんの克服は現代医学の最大テーマの一つであり、その治療法、治療薬の開発に向けて20世紀から多くの研究が積み重ねられてきた。宮坂貞氏は澤田誠吾氏、横倉輝男氏らと共同して研究開発を進め、大腸がん、胃がんをはじめとする多くのがんに効果のある治療薬「塩酸イリノテカン」の開発に成功し、日、仏、米をはじめ世界100カ国で承認され、広く世界のがん患者に恩恵をもたらした。宮坂氏らの業績は研究開発のみならず、日本発の抗がん剤として1000億円の市場を達成し、それを通して多くのがん患者の治療に貢献したもので、山崎貞一賞に誠に相応しいものと判断し本年度の受賞者として選出した。
宮坂氏らは抗腫瘍効果があるとされながら副作用のためにその使用が断念されたカンプトテシンの化学構造の変換を目指し、多くの候補化合物を独創的な手法で合成し、その中から、多岐にわたる生物試験など様々な困難を克服して前臨床研究、治療研究を推し進め、最終的に塩酸イリノテカンの開発にこぎつけた。初期開発から市場開拓まで我が国で主導的に進められた医薬品開発の先駆的な成功事例であり、今回の受賞が我が国の創薬研究を一層刺激し、活性化するものと期待される。尚、現在は特許権が切れ、多くのジェネリック薬品が市場に出ているが、それはこの抗がん剤の有用性を示しており、この業績の波及効果の大きさを示すものと言える。
以上の理由により、宮坂氏、澤田氏、横倉氏の三氏を第13回山崎貞一賞バイオサイエンス・バイオテクノロジー分野の受賞者とする。
研究開発の背景
1966年、M. E. Wall らは米国におけるがん撲滅運動の一環として世界各地の天然から得られる物質の抗腫瘍活性を調べ、中国原産の落葉高木「喜樹」学名:Camptotheca acuminata Decsne から単離された新物質をCamptothecin(カンプトテシン)と命名し、その化学構造を決定した。

写真1 喜樹(キジュ) 和名:カレンボク葉(左)、花(右上)、種子(右下)
カンプトテシンそのものの生理活性検索の段階でマウス実験移植腫瘍系に対する抗腫瘍活性が確認されたことから、米国国立がん研究所(NCI)は1970年代前半に臨床試験を実施した。しかし骨髄抑制や出血性膀胱炎など重篤な副作用を認め、治療薬としての開発を断念した。前臨床試験や臨床試験に入るためには数多くの候補化合物から選び抜かれた最適の物質について科学的方法で充分な吟味を行わなければならない。天然から得られたカンプトテシンを出発物質として使用できれば、これに新しい化学反応を行えば、1工程で新規化合物に変換することができ、工程の長い全合成に頼るよりは遥かに効率が良く、多くの検体を用意できるはずである。
業績内容
現在では臨床治験に入る以前に綿密な前臨床研究が要求され、それに耐える構造を提起するには原体の化学的性格を掘り下げ、動物試験による生理的特性をも評価しつつ原体より放射状に化学変換を行うべきと考えた。そしてキノリン(A,B環), ピロリン(C環),α-ピリドン(D環),δ-ラクトン(E環)の五環が縮合したカンプトテシン(図1(1))の構造のうち、立体的に特異な構造:不斉炭素原子を有し、分極した官能基を持つE環とD環はできるだけそのままにし、ほとんど平面構造をとる非分極性のA, B, C環のC-H結合にできるだけ平面構造を崩さない置換基を導入する方針を立てた。本研究の活性の検定に関しては、L1210担がんマウスを用いる延命率の測定を基準とした。丸ごと動物whole animalを使用する方法では検体となる物質は最低100ミリグラムは必要となり、化学合成班の負担は非常なものであったが、極めて精密な情報が得られた。
水にも有機溶媒にもほとんど難溶性のカンプトテシンの化学変換は極めて困難であったが、希塩酸には溶解しないこの物質も、濃硫酸には塩を形成してよく溶けることに注目し、濃硫酸中のラジカル的アルキル化(Fenton酸化試薬の条件下、脂肪族アルコールやアルデヒドをラジカル源として反応させる:炭素原子1個減成したアルキル化など)や硫硝酸によるA環9位または12位のニトロ化、B環を接触還元してA環をアニリン誘導体に導いた後にニトロ化(11位ニトロ体)、あるいはアセトアニリド誘導体に導いた後のニトロ化(10位ニトロ体)を経由して、いずれもアミノ体、ヒドロキシル体、アルコキシ体、ハロゲノ体等に導いた。10−ヒドロキシル体は極めて微量であるが、天然からも分離されていて、毒性が低い物質との評価があったが、臨床を前提とする研究には不足していた。また10-hydroxycamptothecinはカンプトテシン-N-オキシドの光化学反応によっても好収率で得られた。この方法は工業的方法としても有効で、イリノテカンの製造工程に組み込まれている。最も優れた物質として7-ethyl-10-hydroxycamptothecin(SN-38、図1(2))を選定し、10位ヒドロキシル基を介して水溶性化を試み、多くの化合物の中からピペリディノピペリディノ基がウレタン結合を経由して結合したイリノテカンは塩酸塩とすることで水溶液として安定かつ点滴静注に耐える物性を持つ化合物(図1(3))である。
従って国際一般名はIrinotecan Hydrochloride Trihydrate日本名:塩酸イリノテカン 三水和物 となる。
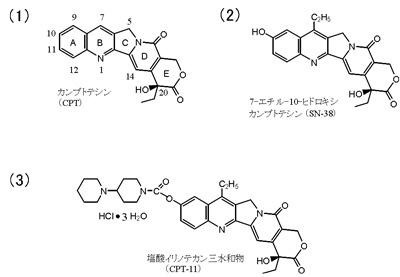
図1 カンプトテシンから塩酸イリノテカンへの化学変換
本業績の意義
複素環化学の基礎研究をもとにカンプトテシンの誘導体を合成し、担がんマウスの延命率をメルクマールとしてそれらの抗腫瘍活性を評価し、カンプトテシン誘導体の構造活性相関を確立した。最も優れた化合物7-ethyl-10-hydroxy-camptothecin(SN-38)を選択し、その10位水酸基をウレタン結合で水溶性官能基(ピペリディノピペリディン・塩酸塩)と連結した化合物:塩酸イリノテカン(CPT-11)を得た。多くの前臨床研究の後、科学的根拠をもとに臨床治験を行った。1994年(日)、1995年(仏)、1996年(米)の各国厚生省に認可され、2002年までに世界100カ国で承認された。消化器がん、肺がん、婦人科がん等の領域で従来の代謝拮抗薬5FU等とは全く異なるタイプの作用機序(DNAトポイソメラーゼⅠの阻害作用)を持つ抗がん剤として、特に大腸がんに対しては単剤投与や併用療法において第一選択薬の地位を譲らない重要な役割を果たしている。研究開始から承認まで17年かかったが、承認後さらなる19年を経た現在も医療・学術両面において高い評価を得ている。作用機序が全く新しいことから他の医薬品との併用療法において相乗効果を発揮し、平均延命率の向上に大きな役割を果たしている。
FOLFIRI(フォルフィリ)療法とは葉酸誘導体・5FUおよびイリノテカンを取材とする併用療法を示し、この療法により平均延命率が25カ月に達している。
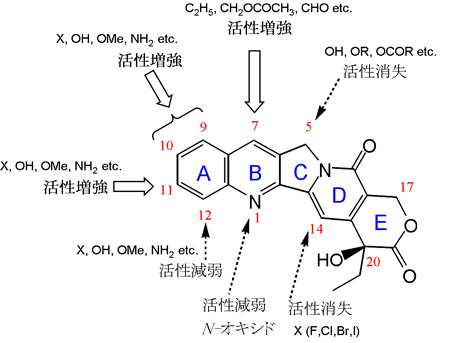
図2 構造活性相関
