第14回(平成26年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
オピオイド受容体のタイプを選択するリガンドの創出と医薬への適用
| 受賞者 | ||
|---|---|---|
| 長瀬 博(ながせ ひろし) | ||
| 略歴 | ||
| 1976年 | 3月 | 名古屋大学 大学院理学研究科 博士課程修了 |
| 1976年 | 4月 | 東レ株式会社 基礎研究所 入社 |
| 1997年 | 4月 | 東レ株式会社 基礎研究所 副所長 |
| 2001年 | 4月 | 東レ株式会社 医薬研究所 所長 |
| 2004年 | 4月 | 北里大学 薬学部 教授 |
| 2013年 | 4月 | 筑波大学 国際統合睡眠医科学研究機構 教授 |
| 現在に至る | ||
授賞理由
モルヒネに代表されるアヘン類縁物質(オピオイド)には強力な鎮痛作用など優れた薬理作用があるが、薬物依存性等の副作用のため、その使用は末期がんなどに限定されてきた。長瀬博氏は細胞表面のオピオイドの受容体に3つのタイプ(μ、δ、κ)が存在することに着目し、依存性の原因となるμ受容体への結合を回避し、一方で、δとκ受容体それぞれに高い選択性を有する拮抗薬(受容体に結合してその作用を抑制する薬物)、さらに、κ受容体の選択的作動薬(受容体に結合してその作用を活性化する薬物)の開発に成功した。特にκ受容体作動薬のナルフラフィンは世界で初めて薬物依存性や幻覚、幻聴などの薬物嫌悪作用を克服した薬である。
ナルフラフィンには、痒みを抑える優れた効果もあり、耐えがたい掻みに苦しむ多くの腎透析患者をその苦しみから解放した。さらに、長瀬氏は、これらの受容体タイプ選択的薬物が鎮咳、抗鬱、抗不安、抗頻尿、抗マラリア、抗がんなどの多彩な薬理効果を有することを見出し、依存性と嫌悪性を克服した新たなオピオイド系薬物に新しい領域を拓きつつある。
以上の理由により、長瀬氏を第14回山崎貞一賞バイオサイエンス・バイオテクノロジー分野の受賞者とする。
研究開発の背景
モルヒネに代表されるオピオイドは、強力な鎮痛作用をはじめとした優れた薬理作用を有することで知られているが、長年、薬物依存性等の副作用が問題視されておりその使用が制限されてきた。しかし、近年、オピオイド受容体に3つのタイプ(μ, δ, κ)が存在することがわかり、これら3つのタイプの薬理作用を研究する必要性から、各受容体タイプに選択性の高い作動薬や拮抗薬が求められるようになった。Portoghese教授はいち早くμ受容体に不可逆的に結合するβ-FNAを合成し、この拮抗薬を利用して薬物依存性がμ受容体に起因することが報告された。この報告以来、夢の鎮痛薬を求めて熾烈なκ作動薬の創出競争が始まった。
この当時、私はPortoghese教授との共同研究で、ナルトレキソンの基本構造をもとにメッセージ−アドレスの概念を利用してκ拮抗薬、nor-BNI、δ拮抗薬NTIの創出に成功した。これらの拮抗薬とPortoghese教授の見出したμ拮抗薬、β-FNAを利用して世界中でオピオイドの3つのタイプの研究が本格的に開始された(図1)。その一方でδのサブタイプも提唱され、私はその拮抗薬(δ1: BNTX, δ2: NTB)の創出にも成功した。
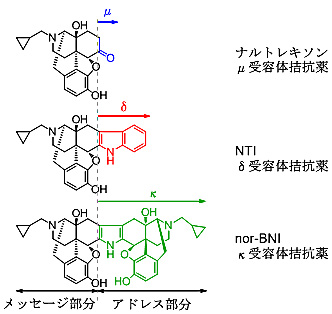
図1 メッセージ−アドレスの概念とμ, δ, κ拮抗薬の構造
業績内容
- 1)オピオイドκ作動薬の設計・合成
上記、κ作動薬の開発競争はアップジョン社が世界で初めてκ選択的作動薬、U-50488Hを発表したことから始まった。すなわち、世界中の製薬会社はこのU-50488Hの構造を模倣した化合物を開発し、熾烈な競争となっていた(図2)。
これらのU-50488H型の薬物は鎮痛作用の確認と依存性の分離という大きな成果をもたらしたが、逆に重篤な薬物嫌悪性(幻覚、幻聴に代表される作用)を発現し、図1に示すタイプの薬物は臨床試験初期に撤退した。
本研究ではアップジョン社の模倣はせず、独自構造を設計・合成した。その設計ではアクセサリー 部位の概念を利用した。すなわち、拮抗薬はその構造にアクセサリー部位と呼ばれる脂溶性部位が付加されており、作動薬はその部位がなくスリムな構造をしているというものである。この概念を利用してκ拮抗薬の脂溶性部位を除去したスリムな構造をした作動薬を合成し、その最適化により最終的にナルフラフィンに到達した(図3)。
幸いにもこのナルフラフィンは鎮痛作用を示し、依存性、嫌悪性ともに分離に成功した初めての薬物となった。
そこで、術後疼痛を適用に臨床試験を進めた結果、鎮痛効果を示す用量で重度の鎮静作用(眠気・ふらつき)が発現し、術後疼痛の適用は断念した。
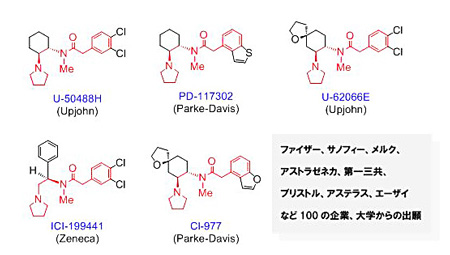
図2 世界中で開発した代表的なκ作動薬の構造
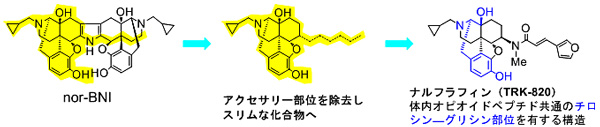
図3 アクセサリー部位の概念とκ作動薬ナルフラフィンの設計・合成
- 2)腎透析患者の重篤な掻痒症への適用と薬物依存性治療効果
上記理由から、他の適用を模索した結果、腎透析患者が重度の掻痒症に悩んでいるとの情報を得て、その動物試験、臨床試験で効果を確認し、遂に難治性そう痒症治療薬として上市に成功した。尚、他社のκ作動薬はこの適用症においても嫌悪性が問題となってしまったため未だ上市されていない。また、このナルフラフィンは鍋島俊隆教授(名古屋大学医学部)、鈴木勉教授(星薬科大学)と共に実施した国家プロジェクト(“依存性薬物により誘発される精神障害の機構の解明の研究”)で、メタアンフェタミン、モルヒネ、コカイン、ニコチン等ほとんどの依存性薬物に対する治療効果があることを確認した。またその機序として、側座核におけるドパミン遊離抑制作用が関係していることを明らかにした。
- 3)δ作動薬の設計・合成と抗鬱抗不安作用治療効果
一方、δ受容体作動薬についても研究を重ね、NTIの構造からアクセサリー部位を除去する手法により、δ受容体高選択的作動薬TAN-67およびその血液脳関門の透過性を改善したKNT-127を設計・合成した(図4)。これらの作動薬は、これまでの他社の作動薬が開発に成功出来なかった理由の一つである重篤な副作用(痙攣、カタレプシー)を完全に分離しており、KNT-127に関しては従来のδ受容体作動薬の100倍以上の作動活性を示した。さらに、新規な骨格のδ作動薬も新たに見出し、これらの化合物を用いて鎮痛効果のほかに、抗鬱、抗不安作用および頻尿症治療効果も見出した。本研究はその効果と実用性を高く評価され、JSTのA-STEP(研究成果最適展開支援プログラム、シーズ育成タイプとハイリスク挑戦タイプ:いずれも日本ケミファ社との共同研究)に採択されており、現在も精力的に研究展開している。
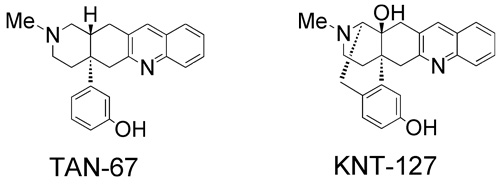
図4 δ 作動薬、TAN-67およびKNT-127の構造
- 4)拮抗薬の適用症の発見
上記拮抗薬の創出は、その後のオピオイド受容体タイプの詳細な薬理作用の解明(特に、δ、κ作動薬は依存性の分離が可能であるという画期的な発見)に繋がった。さらにNTIの強力な鎮咳作用を見出し、依存性が無く、コデインの100倍以上活性の高い鎮咳薬(TRK-851)として臨床試験に進階させた。また、δ1拮抗薬BNTXが薬物耐性マラリアに対する耐性解除作用を有することを見出し、しかもそのBNTX誘導体は、マラリアだけではなく広い範囲で感染性原虫の成長を阻害することも見出した。興味深いことに、この耐性解除の機序はグルタチオンそのもののみではなく、その薬物排出トランスポーターも阻害することから、CD44の阻害に繋がる可能性があり、この事実は耐性癌の治療薬創出への大きな第一歩として期待されている。
本業績の意義
オピオイドはその依存性のため、長年麻薬として扱われてきたが、申請者らの研究成果により今や麻薬性の分離は可能となった。そしてこの新しい認識・発見は、オピオイドが鎮痛作用ばかりでなく、鎮咳、止痒、抗鬱、抗不安、抗頻尿、抗マラリア、癌細胞の血管新生抑制等の多くの作用を有するという新発見に繋がっており、人類の健康問題への大きな貢献となった。さらに、ナルフラフィンの創出は痒みの機序の解明にもつながり、ピッツバーク大学との共同で痒いと引っ掻く理由も発見した。
