��17���ʿ��29ǯ�١˻������ޡ��Х������������Х����ƥ��Υ�����ʬ��
�ָ��ץ����֤�����Ū��̩��ȯ����ʪ������ΰ�Ǥμ��Ѳ�
| ���� | ||
|---|---|---|
| ���� �پȡʤ���� �䤹�Ƥ�� | ||
| �� | ||
| 1995ǯ | 3�� | ��������ر����طϸ������β�����λ�� ��Ρ����ء� |
| 1995ǯ | 4�� | ���ܳؽѿ��������̸������PD�� |
| 1997ǯ | 5�� | ��������ر����طϸ���ʡ����� |
| 2005ǯ | 10�� | ��������ر����طϸ���ʡ��ڶ��� |
| 2010ǯ | 1�� | ��������ر���طϸ���ʡ������ʸ���̳�� |
| 2013ǯ | 10�� | �����ذ�طϸ���ʡ����� |
| ���ߤ˻�� | ||
������ͳ
������Τϡ����ߤ���ʪ������ΰ�ˤ�����ǽ����Ѥΰ�ĤǤ���饤�֥�����ˤ����ơ�ʬ���⥹�ԥ��IJ��Ȥ�������Ū���ۤ���̩��ʬ���߷����˴�Ť������ʷָ��ץ�����ʬ�Ҥ�ȯ���Ƥ�����������Ѥ�����������������˦����ʹ�¤�����Υ����ʥߥ�����Ķ����������Ǽ¾ڤ���ʤ�¾���ɿ������ʤ���Ū�����̤�Ƥ��롣
���ˡ���Τ���ȯ������������ηָ��ץ����֤����⳰�ǻ��Τ��졢��������ʪ����ظ�����礭�������Ƥ��������ɮ���٤����̤Ǥ��롣�������Τϡ����ؤϼ³ؤǤ���Ȥ�����ǰ�θ��ˡ����θ���ǻȤ���ָ��ץ����֤γ�ȯ���꤬�����Ƕᡢ�����������̤����Ļ벽�������Ū�ʥ��ץ졼�ץ����ֵ��Ѥγ�ȯ�������������Ѳ��ؤ�ƻ�ڤ�Ĥ��Ƥ��롣�ʾ���ͤˡ�������Τϴ��ä�����Ѥ˻��ޤ�����Ū�ʻ��������¿���ηָ��ץ����֤�ȯ�������Ĥ��μ��Ѳ��ޤǤ����Ƴ���Ƥ���ȸ������ǻ��������Ԥˤդ��路���Ȥη����˻�ä���
�ʾ����ͳ�ˤ�ꡢ��������17�������ޥХ������������Х����ƥ��Υ�����ʬ��μ��ԤȤ��롣
���泫ȯ���ط�
�ָ��������ˡ�ϡ������Ƥ�����֤κ�˦��ưʪ����ǵ�������ݤ�������¬���뵻ˡ�Ȥ��ơ��������ʪ�ظ����ɬ���Բķ�ʵ��ѤȤʤäƤ��롣 ���δ�¬�μ¸��ˤϡ���¬�о�ʬ�Ҥ��˦������Ļ벽����ַָ��ץ����֡פȸƤФ�����ǽ��ʬ�Ҥγ�ȯ��ɬ�ܤǤ��ꡢ�ָ��饤�֥���������ݤϡ��ָ��ץ����֤ε�ǽ���礭����¸���롣�ָ��ץ����֤ϡ��ָ�����ѥ�����١����Ȥ����Τȡ�ͭ����ʬ�Ҥ�١����Ȥ����Τ����̤���뤬�����Ԥ��ä˸�Ԥγ�ȯ�����ޤǰ�Ӥ��ƹԤäƤ�����ͭ����ʬ�ҷָ��ץ����֤γ�ȯ�ˤϡ��ָ��Ĥηָ�������ǡ������̩�����椹�뤫�����Ȥʤ뤬���ָ�ȯ�����嵯���֤���Ϳ���븽�ݤǤ��뤿�ᡢ�������Τ�ͽ¬�����������¿�̤ʥץ����֤γ�ȯ�Ϻ���Ǥ��ä���
��������
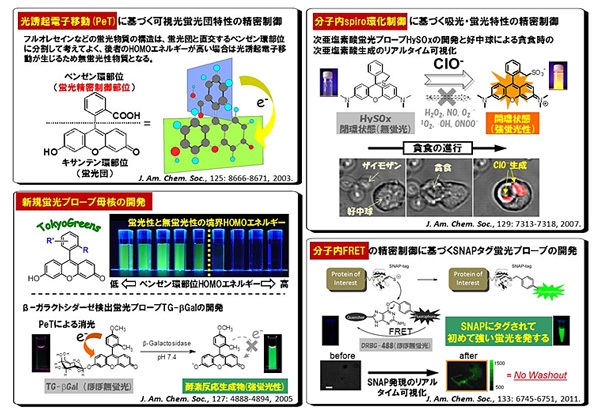
���ԤϤ���ޤǰ�Ӥ��ơ��ȼ��θ����ء�ͭ������Ūȯ�ۤ˴�Ť����ָ�����������̩����˴ؤ��븦���ԤäƤ��������η�̡���Ͷ���ŻҰ�ư��ʬ����spiro�IJ���ư����Ȥ�������Ū�����渶������������櫓�Ƴ�Ω����������Υ饤�֥�������˦��ǽ�����¸��������ǽ��ʬ�Ҥ�¿����ȯ���뤳�Ȥ��������Ƥ���������Ū�ˤϡ���Ͷ���ŻҰ�ư�˴�Ť����ե륪�쥻���������ߥ�ʤɤβĻ���嵯�ָ��Ĥθ�����������̩����ˡ�������ǽ��Ƴ�Ω����TokyoGreen���ʤʤɿ����ָ��Ĥ˴�Ť���¿���μ���Ū�ʷָ��ץ����֤γ�ȯ�����������ʿޣ����塢�����ˡ������Michael�ղ�ȿ���ȷָ��Ĥ���ħŪ��ʬ�ҹ�¤�ߤ˳��Ѥ���ʬ����spiro�IJ�����˴�Ť�����������ʬ���߷�ˡ�γ�Ω�������ǽ�������������Ҥ��뤬����ץ����֤�Ϥ�Ȥ����¿���ηָ��ץ����֤γ�ȯ�����������ʿޣ�����ˡ�����ʳ��ˤ⡢ʬ���ⶦ�ĥ��ͥ륮����ư��FRET�ˤ���Ѥ����������ָ��ץ����֡ʿޣ������ˤʤɡ�50�����Ķ���뿷���ָ��ץ����֤γ�ȯ���������Ƥ�����������ηָ��ץ����֤����������ʥ������¸�����ˤ�Ƽ������ι⤤��ΤǤ��ꡢ�º�30����ʾ�Υץ��������ʤ����˻��β����졢���������ʪ�ϸ���Ԥ���������Ѥ���¿�������̤�Ф��Ƥ��롣
�ޣ����ָ��ץ����֤�����Ū��̩�߷ס���ȯ
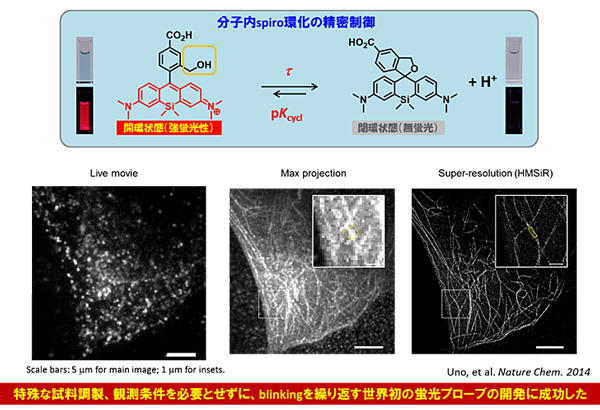
���ԤϤ���ˡ�2014ǯ�ΥΡ��٥벽�ؾޤ�Ϳ����줿Ķ������������Ѥ��ò������ץ����֤γ�ȯ�ˤ����������ʿ�2�ˡ��ȼ���ʬ����spiro�IJ�����ˡ����Ѥ��뤳�Ȥǡ������Ķ����������ץ����֤Ȥϰ�����褹�롢����˦��Ǽ�ȯŪ�����Ǥ��֤�������Υץ����֤�����Ū��ȯ�������������ܥץ����֤γ�ȯ�ˤ�ꡢ���塼�֥��νŹ��æ�Ź���̾�ζ����������ʿޣ�����ˤ���٤ư���Ū�˹�����٤ǥ饤�ִѻ������ʿޣ������ˤʤɡ�����ˡ�Ǥ�ã���Ǥ��ʤ��饤��Ķ�������������¿����ǽ�Ȥʤä����ᡢ�ܥץ����֤�¾��������Τʤ�first-in-class�Υץ����ֳ�ȯ�Ȥ��ơ����⳰�����礭�������줿��
�ޣ�����ȯŪ�����Ǥ���Ķ�����ץ����֤γ�ȯ
����˼��Ԥϡ��ַָ���������ؤϡ���̱�η�٤�����ŵ��ѤȤ��Ƥ�����礭�ʹ����Ǥ���פȤο�ǰ���顢���ؤȰ�ؤ��������ɵ᤹�븦����ǯ��ȯ�˹Ԥ�����Ū�����̤��¿������
������ɽ�㤬���ָ��ץ����֤���̩�߷פˤ����������Υ饤�ַָ��Ļ벽�μ¸��Ǥ��ꡢ�����Ƥ���ưʪ���Τ䴵�������¸�ߤ��������������̤��ξ�ǿ�®�˷ָ����Ф��뤳�Ȥǡ����Τʳ��ʡ����
�����Ť�¸����뵻�ѤǤ��롣���ʤ�����Ԥϡ��ȼ���ʬ���߷��Ѥ��Ȥ��ơ��������̤�������ħŪ�ʹ��dz�����Ļ벽�������������ʷָ��ץ����֤γ�ȯ���������ʿޣ���ˡ��ܥץ����֤�ʢ���ż郎���ǥ�ޥ�����������ͤ���
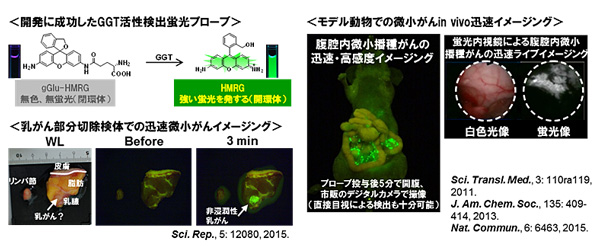
���Ȥǡ�1mm�ʲ�����������Ǥ��äƤ⤳����ܻ�ǽ�ʬ�˸��������뤵�Ƿָ����Ф��뤳�Ȥ����������ʿޣ��溸�ˡ�
����ˡ��������Ǥ����������̤��ܥץ����֤�ʮ̸����ȡ�1ʬ���٤ο�®������������в�ǽ�Ǥ��뤳�Ȥ����餫�Ȥʤꡢ������β��Ū�ʰ��ŵ��Ѥγ�ȯ�����������ʿޣ��汦�ˡ�
����˼��Ԥϡ��ܥ��ץ졼���ץ����֤˿����ʰ��ŵ��ѤȤ��ƾ��ڤ�����٤������⳰20�ʾ���±��Ȥ����ָ�������ͥåȥ������������ºݤΤ���ͳ��ο��������Τ���Ѥ������Ԥä������η�̡������Ĥ��Τ����Ǥ϶ˤ��ͭ���˵�ǽ���뤳�Ȥ����餫�Ȥʤ�ʤɡʿޣ����ˡ����ؤ�
��Ť��������ŵ��Ѥμ¸�Ū������ã�����줿��
�ޣ��������ָ��ץ����֤γ�ȯ�ˤ������®������μ¸�
�ܶ��Ӥΰյ�
���Ԥ���ȯ�����ָ��ץ����֤ˤ��饤�֥������ˡ�ϡ�������ʪ�ؼԤ�������դޤǤ�ï�⤬�Ԥ�˾����Ū�ʵ��ѤǤ��롣�ä˸�Ⱦ�ǾҲ𤷤���������ν����®�Ļ벽���ѤˤĤ��Ƥϡ�����ͭ������¿���̤���ǧ���졢�º�������UTEC��UMI�ʤ�¿���Υ٥���㡼����ԥ��뤫��νл�����ơ��������������Ȥ��ƾ�Ԥ��ܻؤ�������ȯ���������Ȥ��Ƥ��롣�ᤤ���衢¿���δ��Ԥ�̿��ߤ����Ū�ʼ������ѤȤ��Ƽ��Ѳ�����뤳�� ���������Ԥ���롣
