第19回(令和元年度)山崎貞一賞 バイオサイエンス・バイオテクノロジー分野
がん分子標的療法の革新とゲノム医療の実現
| 受賞者 | ||
|---|---|---|
| 間野 博行 (まの ひろゆき) | ||
| 略歴 | ||
| 1984年 | 3月 | 東京大学 医学部 医学科 卒業 |
| 1991年 | 8月 | 東京大学 医学部 第三内科 文部教官助手 |
| 2001年 | 6月 | 自治医科大学 ゲノム機能研究部 教授 |
| 2013年 | 4月 | 東京大学大学院 医学系研究科 教授 |
| 2016年 | 4月 | 国立がん研究センター 研究所長 |
| 2018年 | 6月 | 国立がん研究センター がんゲノム情報管理センター長 |
| 現在に至る | ||
授賞理由
間野氏は、肺がんの新たながん遺伝子EML4-ALKを発見し、上皮性腫瘍でも染色体転座による融合型がん遺伝子が存在することを世界で初めて示した。続いて、EML4-ALKの臨床診断法を開発し、ALK阻害薬クリゾチニブの史上最速の承認に貢献した。また、EML4-ALK内のクリゾチニブ耐性変異を世界に先駆けて発見し、アレクチニブ等の第2世代のALK阻害剤の開発をもたらした。既に日本で承認されたアレクチニブは奏効率94%を示し、固形腫瘍に対して最も有効な抗がん剤として実用化されている。さらに、ALKの異常な活性化によるがん種を「ALKoma」と呼称し、がんを臓器別から原因遺伝子別に分類することを提唱、がんの「ゲノム医療」を先導した。このように、氏は、世界のがん研究・がん医療のパラダイムシフトを牽引し、その業績は基礎から臨床応用まで多岐にわたり、中でも氏の研究成果で世界中の数万人のがん患者の救命が実際にもたらされていることは特筆すべき成果といえる。
以上の理由により、間野氏を第19回山崎貞一賞バイオサイエンス・バイオテクノロジー分野の受賞者とする。
研究開発の背景
がんによる死亡者数は毎年世界で820万人にもおよび、しかも肺がんなど複数のがん種で若年の患者数が増加してきている。がんの克服は人類の最大の希求の一つであるが、外科治療で完治しない患者に有効な抗がん剤は少ない。この様な状況を打開するために、正常の細胞増殖に重要な機能分子を標的とする「分子標的治療薬」が数多く開発されたが、20世紀末の時点で残念ながら単剤でがん患者の予後を改善できる薬剤はほとんど存在していなかった。
受賞者は、ほぼ全ての分子標的治療薬が無効な理由として、それら薬剤が標的とするタンパクが、がん細胞の生存・増殖において必要欠くべからざるものではないためではないかと予想した。恐らく各がん種において少数の本質的な発がん原因タンパクが存在しており、それらを標的とする薬剤を開発すれば新たな特効薬が可能になると予想したのである。
本質的な発がん原因分子を直接標的としていない場合は、がん細胞はゲノムの不安定性を利用して、標的とされた経路が無くても生存可能な変異クローンを用意できるのではないかと考えたのだ。もしこの様な仮説が正しいとすれば、有効な分子標的治療薬開発のためには各がん種における本質的な発がん原因を同定することが何よりも重要となる。
業績内容
受賞者らはそのために新しいがん遺伝子探索技術を自ら開発した。細胞内では遺伝子からメッセンジャーRNAが作られてタンパクとなって機能を発揮する。がんには、直接発がんを促す異常遺伝子由来のメッセンジャーRNAが作られているはずであるから、がんの臨床検体からメッセンジャーRNAを抽出し、相補的DNA(cDNA)に置換後レトロウィルスに組み込んだライブラリーを構築した。このような組換えウィルスライブラリーをマウスの線維芽細胞3T3に感染させると、がん遺伝子が導入された細胞は形態が異常になり検出することができる。
肺がんの患者検体から、上記方法を用いてスクリーニングしたところ、新たながん遺伝子EML4-ALKを発見することに成功した(図1)。
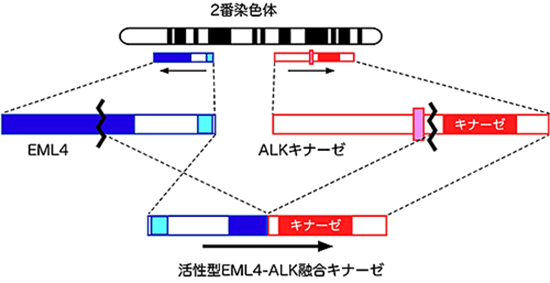
Fig.1 Discovery of EML4-ALKfusion gene
EML4遺伝子とALK遺伝子は正常細胞においてヒトの2番染色体内のごく近い位置に互いに反対向きに並んでいるが、両遺伝子を挟む染色体領域が逆位を形成することでEML4とALK遺伝子が融合した異常遺伝子が作られるのである。以前は、このように染色体の構造異常でがんが発症することは血液腫瘍に限られると考えられていたが、本発見は、代表的な固形腫瘍である肺がんも、それまでの常識に反して血液腫瘍と同様に染色体再構成によって作られることを直接証明するものであった。正常なALKタンパクは細胞の増殖を促す酵素(キナーゼ)であるが、染色体転座の結果EML4と融合して、酵素活性が数百倍にも上昇しがん化酵素となるのである。実際EML4-ALKを肺に発現するマウスを作成すると、生後すぐに何百個もの肺がんを多発発症し、さらに同マウスにALK酵素活性阻害薬を投与すると速やかに肺がんが消失したのである(図2)。
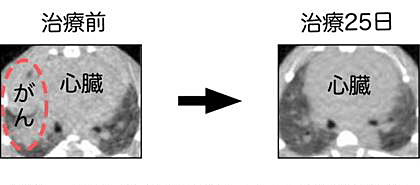
Fig.2 Therapeutic experiment of mice expressing EML4-ALK
本発見を受けて、数多くのALK阻害薬が臨床試験に入ったが、最初に臨床試験を行ったクリゾチニブはその第Ⅰ/Ⅱ相臨床試験において奏効率が約6割にも及ぶことが明らかになった。この目覚ましい治療効果を受けて米国の薬剤承認機関であるFDAは、一般に必要とされる大規模第Ⅲ相臨床試験を不要としてクリゾチニブを承認したのである。EML4-ALKの発見から僅か4年後の承認は、世界の抗がん薬の開発史上最速のスピードであった。
さらに受賞者らは、EML4-ALK陽性肺がんがクリゾチニブに耐性を獲得する機構も解明し、今度はその知見に基づく「耐性を獲得しにくい第2世代のALK阻害薬」開発がもたらされた。中でもアレクチニブは第Ⅰ/Ⅱ相臨床試験において93.5%と言う奇跡のような奏効率を証明し、2014年7月に厚生労働省より肺がん治療薬として認可を受けている。
EML4-ALK の発見はこうして同遺伝子陽性肺がんに特効薬をもたらしたが、同時にがんゲノム医療を先導することになった。ALKはEML4と融合して肺がんの原因となるが、別の肺がんではKIF5Bと融合してがんを生じることが明らかになった。それだけで無く、ALKはNPM1 と融合して悪性リンパ腫を、VCLと融合して子供の腎臓がんを、さらにTPM3/4と融合して肉腫を生じることが示されたのである。つまり一種類のALK遺伝子が様々な形で活性化されて、多臓器のがんの原因となることが示された。受賞者らはこのような活性型ALKによるがん全体を「ALKoma」と呼称することを提案した。つまり発生臓器を超えた、がん遺伝子によるがんの分類法を提案したのである。さらに受賞者らは肺腺がんにおけるROS1融合型がん遺伝子やRET融合型がん遺伝子も発見することに成功し、先のEML4-ALKと併せて、肺腺がんが均一の疾患単位では無く、ALK/ROS1/RETそれぞれの遺伝子の融合が原因となった小さなグループの集合体であることを示した。
本業績の意義
受賞者らの一連の研究成果の結果、患者のがんがどの臓器原発であっても、保険収載された薬剤に対応する遺伝子変異/臨床試験を行っている薬剤に対応する遺伝子変異の有無をすべて調べないと、個々の患者に最適の薬剤を選択できないようになったと言える。それこそが「がんゲノム医療」である。こうして世界は、多数のがん関連遺伝子の配列異常を一度に解析するがん遺伝子パネル検査で治療方針を決定する時代に入ったのである。
日本においても早急にがんゲノム医療体制を構築する必要があり、2018年に厚生労働省は、がんゲノム医療を受ける患者のゲノム情報と臨床情報を集約する「がんゲノム情報管理センター」を設置した。
受賞者がその初代センター長として国民皆保険下でのがんゲノム医療推進に従事しているところである。
