第23回(令和5年度)山崎貞一賞 バイオ・医科学分野
オーキシンデグロン技術による迅速な細胞およびマウス個体内タンパク質発現制御の実現
| 受賞者 | ||
|---|---|---|
| 鐘巻 将人(かねまき まさと) | ||
| 略歴 | ||
| 1996年 | 3月 | 千葉大学 理学部 生物学科 卒業 |
| 2001年 | 3月 | 千葉大学 自然科学研究科 博士課程 修了 |
| 2001年 | 6月 | Cancer Research UK, Post-doctoral fellow |
| 2006年 | 7月 | 大阪大学大学院 理学研究科 助教 |
| 2010年 | 10月 | 国立遺伝学研究所 准教授 |
| 2016年 | 4月 | 国立遺伝学研究所 教授 |
| 現在に至る | ||
授賞理由
鐘巻氏は、植物細胞内でオーキシンが特定の転写抑制因子の分解を誘導するメカニズムに着目し、この分解経路を動物に導入することでオーキシンデグロン(Auxin-Inducible Degron: AID)技術を確立した。このAID技術により、オーキシンを投与することで分解タグ配列を付加した標的タンパク質を特異的に、かつ迅速に分解除去することが可能となった。従来の標的タンパク質除去技術であるsiRNA法では標的タンパク質の分解に24時間以上要していたが、AID技術を用いれば数十分〜数時間以内に分解可能であるため、標的タンパク質除去による直接的影響を観察できるようになった。当初、培養細胞に対して開発されたAID技術は、現在ではマウス個体に対しても利用できるように発展し応用性を高めた(AID2)。また、広く研究者が利用できる様に、AID技術導入試薬の市販および研究材料の配布の体制が整備されている。実際に、AID技術の重要性に世界中の研究者が注目し、AID技術を使用した多数の論文が一流学術誌に報告されている。
以上のように、鐘巻氏はAID技術開発を通じて、生命科学の発展につながる優れた創造的業績をあげている人物であり、第23回山粼貞一賞バイオ・医科学分野受賞者としてここに決定する。
研究開発の背景
細胞内におけるタンパク質の機能を理解するためには、そのタンパク質を取り除いて何が起こるかを観察することが有効である。特に標的とするタンパク質が生存に必須である場合、ノックアウト細胞を作ることができないため、必要な時に標的タンパク質を取り除く技術が重要である。従来から、この目的のためにsiRNAが用いられてきたが、標的タンパク質除去に2〜3日もの時間がかかる。転写ネットワーク、細胞周期、初期発生などの多くの細胞反応は数分〜数時間のスケールで起きるため、siRNAによる標的タンパク質除去では間に合わない。さらに、siRNAはその処理時間の長さから、観察時の影響が直接的タンパク質機能欠損によるものか、除去による副次的影響か区別することは困難であった。
一方で、マウス個体を利用した研究においては、同様の目的でLoxP配列とCreERT2を利用したコンディショナルノックアウトが用いられてきたが、やはり標的タンパク質除去には数日以上の時間がかかる。そのため、生命科学研究を推進するためには、迅速に標的タンパク質を除去できる新たな方法論が必要とされていた。
業績内容
受賞者は、植物がオーキシンにより転写抑制因子AUX/IAAを分解する植物特有のメカニズムを持つことに注目し、このタンパク質分解系を非植物細胞に導入して、新たなタンパク質発現制御法の開発を試みた。植物細胞内において、オーキシン応答反応は、ユビキチン付加酵素複合体を構成するTIR1がオーキシンと結合した時に、AUX/IAAが持つデグロン配列に結合し、ユビキチン化することで分解に導く(図1左)。そこで、培養細胞にTIR1を発現させて内在性因子を利用して機能的ユビキチン付加酵素複合体を構成し、標的タンパク質にデグロン配列を付加したところ、オーキシン依存的に標的タンパク質を分解することに成功した(図1右)。受賞者は本技術をオーキシンデグロン(auxin-inducible degron; AID)法と命名した。
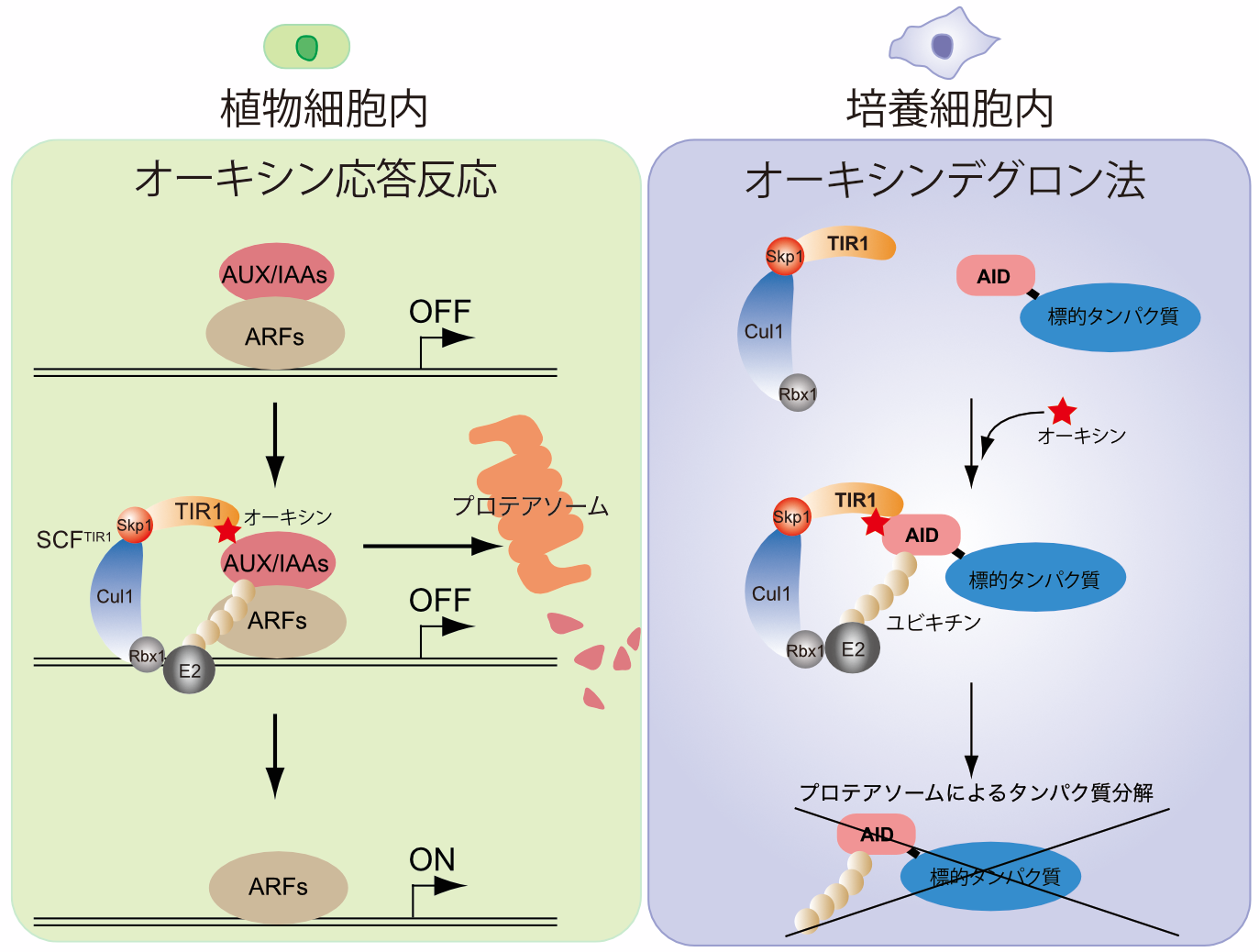
図1 オーキシン応答とオーキシンデグロン法の原理
AID法は、標的タンパク質を半減期数十分で分解することが可能であるため、siRNA等の従来法と比べて、除去時間を著しく短縮することを可能にした。しかし、AID法では、オーキシン非添加時においても、デグロン配列を付加した標的タンパク質が弱く分解される点、分解誘導に必要なオーキシン濃度が数百μMと非常に高い点などの弱点があった。そのため、マウス個体への応用が困難であった。
そこで、受賞者はAID法の改良に挑み、ケミカルバイオロジー的改良を施したAID2の開発に成功した。AID2においては、変異型TIR1とオーキシンアナログ5-Ph-IAAを用いて分解誘導をおこなう(図2)。AID2においては、リガンド非依存的な分解が観察されず、1μM以下の低濃度5-Ph-IAAにより分解誘導が可能であり、分解時間もより短くすることに成功した(図2)。
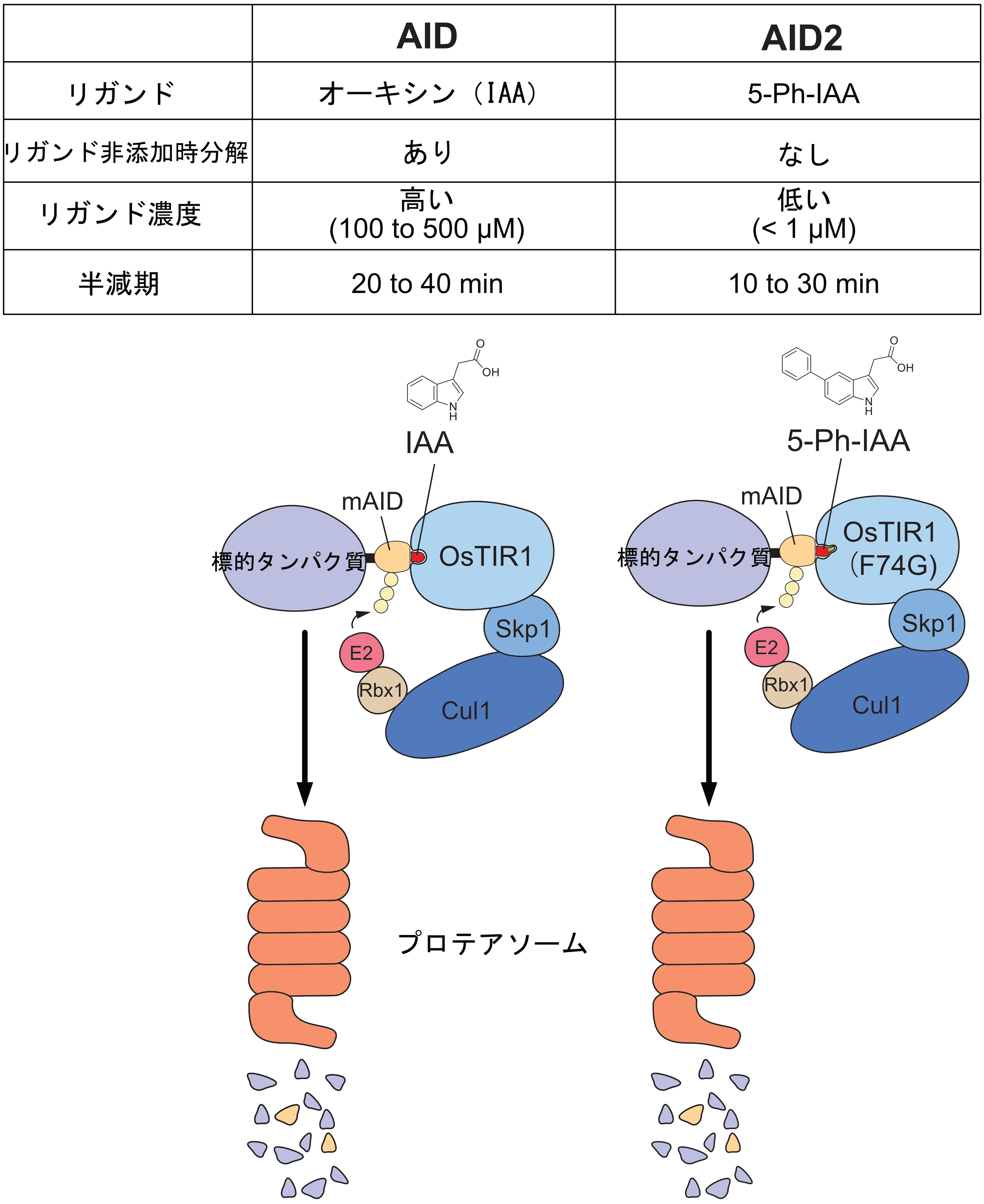
図2 AIDとAID2の作用機序と比較
AID2は出芽酵母、マウスやヒト培養細胞内で非常によく作用するだけでなく、線虫やマウス個体においても分解誘導可能である (図3)。これにより、細胞から個体レベルにおいて、迅速に標的タンパク質を分解することに成功した。
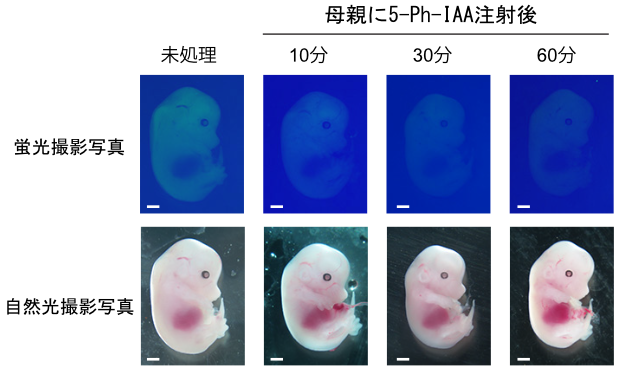
図3 GFPレポーター導入マウス胎児における分解誘導
AID2を利用して細胞内のタンパク質発現を制御するには、内在性の標的遺伝子にデグロン配列を挿入する必要がある。そこで、受賞者はAIDとAID2の開発と併せて、CRISPR-Cas9ゲノム編集による内在性遺伝子へのデグロンタグ挿入法も開発した。開発した遺伝子改変法を論文発表するとともに、必要なプラスミド材料を日本のバイオリソース機関NBRP及び海外のプラスミド配布機関addgeneに寄託し、世界中の研究者が自由に材料を入手できる体制を構築し、AID及びAID2技術の普及に努めた。その結果、これら技術は世界的に浸透し、すでに細胞生物学では広く使われ、その成果がトップジャーナルに報告されるようになっている。
本業績の意義
本業績の意義は、さまざまな細胞から動物個体にまで広い汎用性をもつ、迅速なタンパク質分解技術を開発したことにより、世界的に生命科学研究の発展に寄与した点にある。これまで、種を超えて細胞から個体までタンパク質除去を可能にした方法はないため、AID2法は酵母などの単細胞モデル生物から、幹細胞やマウス個体を利用した分野まで、広範な研究分野において利用され、新たな生命現象の発見とそのメカニズム解明に寄与するだろう。
また、生命科学研究においては、生命現象の発見とそのメカニズム解析といった伝統的な方向性だけでなく、細胞を人為的に制御し、新たな機能を付加するアプローチも模索されている。AID2は新たな制御を付加することを可能とするため、例えば必要な時に有用化合物生産や細胞分化を誘導するなどの、新技術開発にも寄与することができる。
創薬研究においては、現在タンパク質分解薬として期待されるPROTACの作用評価バリデーションに役立つことが期待される。受賞者は、AID2をもとに非モデル生物や医療においても利用可能な標的タンパク質分解法の開発を継続している。将来的には、PROTACと異なったアプローチで、タンパク質を分解誘導することにより作用する新規治療法の開発に貢献できるかもしれない。
