第14回(平成26年度)山崎貞一賞 計測評価分野
単一細胞内微小局所質量分析法の創成と創薬・生命医科学展開
| 受賞者 | ||
|---|---|---|
| 升島 努(ますじま つとむ) | ||
| 略歴 | ||
| 1972年 | 3月 | 広島大学 理学部 物性学科 卒業 |
| 1980年 | 2月 | 広島大学大学院 理学研究科 単位取得退学 |
| 1980年 | 3月 | 広島大学 医学部 総合薬学科 助手 |
| 1989年 | 6月 | 広島大学 医学部 総合薬学科 教授 |
| 2002年 | 4月 | 広島大学大学院 医歯薬学総合研究科 教授 |
| 2011年 | 4月 | (独)理化学研究所 生命システム研究センター チームリーダー |
| 現在に至る | ||
授賞理由
本件は単一細胞内小器官成分を微細管で捕捉、直接ナノスプレーイオン化する方法で、数分でそこに存在する数千の分子群を網羅的に検出することに成功し、生命科学の革新的分析法を創成した。
日本の製薬企業にいち早く公開すると共に恊働して、10分以内に、新薬候補分子の薬理作用、局在性、代謝作用、毒性を単一細胞で同時に評価できる「単一細胞創薬」技法を確立し、世界の関係企業の注目を集めている。さらに血中循環腫瘍細胞(CTC)や無痛で採取可能な超微量血液での分子パターンの検出にも成功し、未来の分子診断法への道を創成した。更に植物分野では基礎から植物工場、農業まで幅広い新応用が世界規模の共同研究で進んでいる。
候補者が25年余をかけて確立した本手法は、関連基本特許の取得も含め日本で生まれ、世界の創薬・生命医科学を革新しつつある。
以上の理由により、升島氏を第14回山崎貞一賞計測評価分野の受賞者とする。
研究開発の背景
生体の単位「細胞」をビデオ顕微鏡で見ながら、その生命現象の巧みさを見た時、その構成分子群をすぐに網羅的に質量分析で捉えられたら、生命の分子メカニズムはもっと詳しく明快に分かると思った。「1細胞分析」は、今や世界的ブームにもなってきたが、当時は、田中氏のノーベル賞受賞となったレーザー照射によるMALDI-TOF⁄MS法、今はそのレーザー照射をスキャンして画像として捉える質量顕微鏡もあるが、いずれも、脂質などイオン化しやすい分子のみが強く検出され、細胞内部の分子を網羅的に捉えるには不十分で、感度も分子同定力も低く、全く異なる手法開発が必要だと考えた。
業績内容
[発想から実現まで]
1999年ミレニアムシンポジウムに招かれ、それを可能とする革新的手法として「顕微鏡観察」+「分子を網羅的に捉える質量分析」=「ビデオマススコープ」を提案した。細胞一ヶを、顕微鏡観察下見たい瞬間、直接マイクロキャピラリーを細胞に差し込み成分を吸引捕捉する。しかし、そのまま試料導入しても、全く信号が出なかった。7年間の試行錯誤の末、図1の様なマイクロキャピラリーに金コートしたナノスプレーチッ プで刺し、図2の様に、細胞を吸引捕捉し、次に先端の1ピコリッター以下の超微量の1細胞捕捉成分に、チップ後端からイオン化溶媒を入れて、質量分析計とチップ間への電場印加のみで発生するナノスプレーで質量分析計に直接試料導入すると、沢山の低分子らしきピークが見えた。その信号は数分間続き、この間に全体のスペクトル(網羅的分子検出)、そして、分子ピークを選びその分子を壊してみるMS⁄MS測定(構造解析・分子同定)もでき、スペクトル差から、分子ピークの状態差や局在差も抽出できる事に世界で初めて成功した。

図1 ナノスプレーとチップ
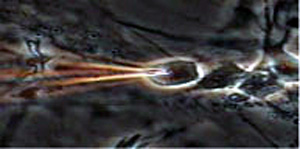
図2 神経分化細胞の選択的捕捉
「生きた細胞を観ながら、細胞膜脂質を刺入で避け、細胞質のみでなく今や小器官一ヶでも内部分子群を2000分子以上網羅的に検出できる。その間5分以内、分子同定も可能な理想に近い1細胞迅速超感度分子検出が可能となった。差分解析で、状態や部位間での特異分子も抽出でき、生命分子機構解明のみでなく、その応用範囲はきわめて広い手法」を初めて確立した(図3)。
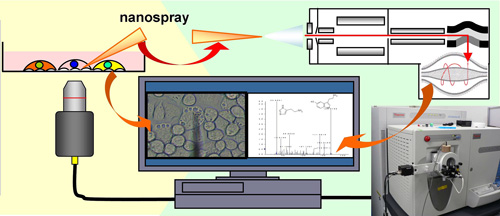
図3 1細胞質量分析法の概要
本業績の意義
-
1)1細胞創薬(Single Cell Drug Discovery)法
ヒト初代培養細胞一ヶで、新薬候補の薬理・局在・代謝・毒性まで、5分程度の測定で多面的評価が出来る世界初の"Single Cell Drug Discovery" と題して、2014年6月、世界中の製薬企業質量分析者が集まるアメリカ質量分析学会での講演に選ばれ、日本製薬企業4社との長年の共同研究成果を発表した。立ち見が出た発表の後、世界大手製薬企業3社から反響があり、GSK社とはネットで世界全研究所を結んだ再講演を10月に行った。フランス大手SANOFI社からも多くの予備試験が委託された。動物試験が禁止されつつある動向の中、今後の新創薬技術として、世界展開がいよいよ始まる。
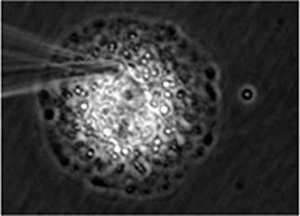
図4 ヒト初代培養肝細胞内の薬物成分捕捉
-
2)1細胞・超微量体液無痛分子診断法への応用
体液一滴、痛くない多面的な分子臨床診断、健康モニタリングは分子診断の未来像である。今後の分子診断は質量分析に代わると言われる未来医療に、本法の超微量で迅速な網羅的分子検出能は大きな強みである。図5は、ヒトの指の汗腺一ヶからの汗一滴からの分子検出、しかし、その量は細胞一ヶの1000倍と簡単で、そこから検出された分子群は、食生活、体質、健康状態に加え、飲酒、喫煙、薬物、カフェインなどの摂取成分も検出できた。現在、情報大手企業と未来医療研究プロジェクトと連携して、そのデータ蓄積、解析、指標構築を含む、実証研究を進めている。また、国立がんセンターと共同で、がん転移の元凶CTC(血中循環がん細胞)の分子像検出に成功し、今後の細胞分子診断にも道を拓きつつある。
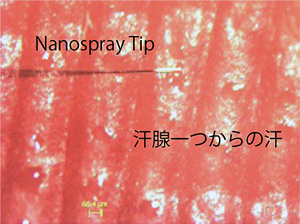
図5 ヒト指先汗腺一つからの汗の捕捉
-
3)植物細胞分析から、次世代農業への応用
植物細胞はサイズも液胞も大きく、本法で最も容易な細胞である(図6)。
大手電機メーカーと植物工場の環境条件検討としてLED照明波長と植物内産生分子変動との相関解析、また、他社と花弁細胞液胞内のフラボノイド配糖体の確認や、茶葉細胞中のカテキン類の直接分析を異性体も分離して直接検出する等、有用作種の創成、確認にも利用でき、米の白濁など植物の病因分析などにも、広く利用され始めている。
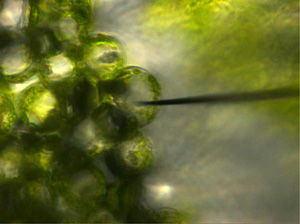
図6 植物1細胞の捕捉
-
4)基礎生命科学への貢献
生きた細胞の動きを観察しながら、数分で網羅的分子検出。これは我々が注力する基礎生命科学でも未来手法としてどれほどの可能性を持っているかは、共同研究の多さからも伺う事ができる。
1細胞からすでに細胞内1小器官へ、そして更に逆に、世界がまだなし得ていない多細胞間の分子対話も含めた組織形成の必然へ、その挑戦と可能性は広がっている。
